


國(guó)外汽車密封條技術(shù)標(biāo)準(zhǔn)和規(guī)范概況

關(guān)注|關(guān)于擬新建8項(xiàng)國(guó)家計(jì)量基準(zhǔn)和提升1項(xiàng)國(guó)家計(jì)量基準(zhǔn)技術(shù)能力的公示..

公司客戶-資陽中車電氣現(xiàn)場(chǎng)評(píng)審順利通過

雙峰22輛校車檢測(cè)不合格 廠家卻不認(rèn)可
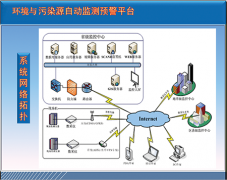
環(huán)保部:環(huán)境監(jiān)測(cè)將“國(guó)家考核”