


國(guó)家重大科學(xué)儀器專(zhuān)項(xiàng)巡視檢查順利結(jié)束

能力驗(yàn)證常見(jiàn)問(wèn)題及解答

國(guó)家海洋局:天津爆炸事故周邊海域監(jiān)測(cè)無(wú)異常
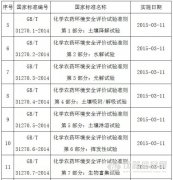
國(guó)家標(biāo)準(zhǔn)委批準(zhǔn)發(fā)布21項(xiàng)農(nóng)藥環(huán)境安全評(píng)價(jià)國(guó)家標(biāo)準(zhǔn)

萬(wàn)級(jí)無(wú)菌室和P2實(shí)驗(yàn)室的區(qū)別